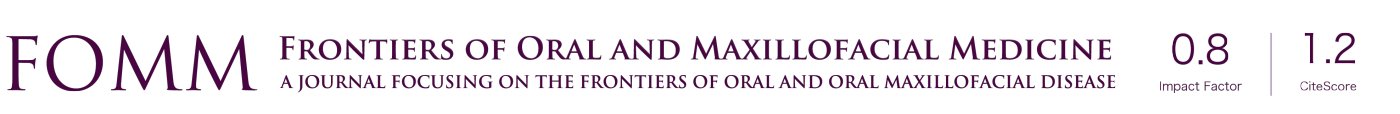口腔癌远处转移的危险因素及术前检测策略
前言
口腔癌的远处转移一般是指肿瘤播散累及锁骨以下组织或器官[1],对于OSCC的治疗和预后至关重要。具体来说,在初诊或随访期间发现远处转移的病例中,总生存率显著下降[2]。对于来自口腔癌的远处转移,舌根是最常见的原发部位,其次是舌尖、口底、颊和上颌骨。肺是远处转移最常累及的器官,其次是骨、皮肤、肝和脑。据报道,初诊时远处转移的发生率为1%~3%[3,4],但在随访期间提高至15%。因此,基于风险因素评估建立识别高危患者的方法很有价值。T分期、N分期、ECS和肿瘤厚度等临床或组织病理学因素与OSCC发生远处转移有关[5]。本研究的主要目的是明确OSCC患者发生远处转移的相关重要因素,并制定早期发现远处转移的方案。
方法
2009—2017年,共有297例原发性OSCC患者于西班牙阿尔巴塞特医院诊断并进行手术治疗,部分患者采用了辅助治疗。本研究不包含口咽癌患者。所有患者的活检结果均为鳞癌,在根治术前行颌面部CT检查以明确临床分期,术后组织病理学诊断均为OSCC。医院病理科既往根据UICC分期第五版确定原发肿瘤的临床和病理分期[6],但在本回顾性研究中根据UICC分期第八版确定临床和病理分期[7]。纳入的病理特征包括T分期、N分期、肿瘤厚度、PNI、血管侵犯、ECS、复发、对侧颈部淋巴结受累、病理分期、年龄和性别。肿瘤厚度分为<0.5 cm、0.5~1 cm和>1 cm 3组,年龄分为<40岁、40~60岁和>60岁3组。
本研究为回顾性研究,不需要医院的伦理批准。涉及参与者的所有程序均符合医院和国家研究委员会的伦理标准以及《赫尔辛基宣言》(2013年修订),并已获取患者的书面知情同意。
统计分析
使用SPSS 23v软件进行统计分析,对变量进行相关性检验,运用频率和百分比描述性别、年龄、远处转移等变量,采用卡方检验验证有无远处转移患者之间的差异,并使用列联表分析变量对发生远处转移风险的影响,使用Cox回归分析验证各变量与远处转移的关系及风险比(hazard ratio,HR),P值设定为0.05,最后运用Kaplan-Meier检验进行5年总体生存分析。
纳入标准
术前活检结果为OSCC并在本中心进行根治性手术,随访期间出现远处转移的患者,有完整的术前影像学检查,包括颌面部MRI或CT。
排除标准
口咽癌患者,术前已有远处转移证据的患者。
变量
本研究分析的变量包括T分期、N分期、肿瘤厚度、PNI、血管侵犯、ECS、复发、对侧颈部受累、病理分期、年龄和生存率。
结果
297例患者在此期间进行了OSCC的手术切除,部分患者采用了辅助治疗,包含206名男性(69.4%)和91名女性(30.6%),男女比为2.09。患者年龄为29~92岁(平均63.97±11.80岁),随访时间为3~71个月(平均23.83±15.09个月)。
远处转移的发生率为13.5%(n=40),肺部转移最常见(n=25,62.5%),其次是骨(n=3,7.5%)、肝(n=2,5.0%)和肾上腺(n=2,5.0%)。此外,7例患者(17.5%)出现多发转移,1例患者(2.5%)伴发癌性淋巴管炎。19例患者和7例患者分别在随访第一年(47.5%)和第二年(17.5%)出现远处转移。然后有14例患者(35.0%)在术后3个月内出现远处转移,在开始辅助治疗前或结束辅助治疗后进行的胸部CT或PET检查中被发现,即在所有患者中有4.7%存在远处转移的早期表现,且我们的分期方法(临床表现+颌面部CT)未发现远处转移,不能排除这些患者在进行根治术前就已出现远处转移的可能性。
T分期T3、T4(P<0.001),N分期N2、N3(P<0.001),肿瘤厚度>1 cm(P<0.001),PNI(P<0.001),ECS(P<0.001),颈部及局部复发(P<0.001),临床/病理分期IV期(P<0.001)以及对侧颈部受累(P<0.005)等因素与发生远处转移高度相关。令人关注的是,血管侵犯、年龄和性别与发生远处转移的风险无关(P>0.005)。关于每个亚组的具体数值及其与发生远处转移相关性的进一步细节在表1中展示。
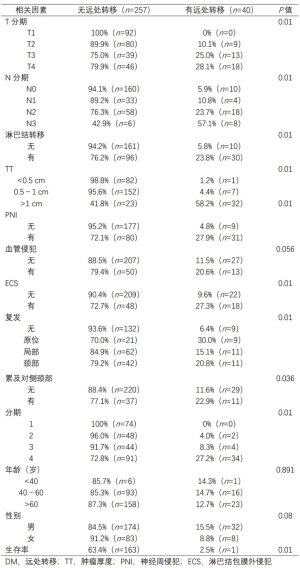
Full table
根据Cox回归分析的结果,pT3、pT4分期肿瘤患者发生远处转移的风险高2.227倍,N2、N3分期的患者高3.123倍,肿瘤厚度>1 cm的患者高1.90倍,颈部或局部复发患者的风险高3.082倍,临床/病理分期IV期患者高2.651倍。关于具体HR值的信息在表2中详细列举。此外,存在2个及以上危险因素时,发生远处转移的可能性将提高4倍。
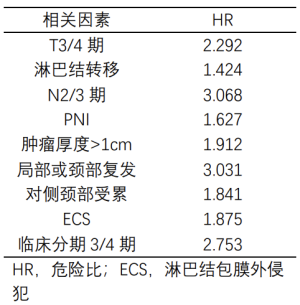
Full table
重要的是,随访期间没有发生远处转移患者的总生存率为63.4%,而发生远处转移的患者仅为2.5%(图1)。
讨论
已有多项研究探讨了口腔癌远处转移的发生率和危险因素[3,5,8,9]。然而,这些研究都没有区分接受手术治疗的患者和未接受手术的患者。此外,这些研究都纳入了口咽癌患者。由于接受放化疗或手术治疗的口咽癌患者可能会表现出相似的生存结果,因此这种区别很重要。并且与影响口腔其他部位的SCC患者相比,他们可能表现出更高的远处转移趋势[3]。本研究中,我们对一组特定的接受手术治疗的口腔癌(不包括口咽)患者进行分析,部分患者采用了辅助治疗。其中远处转移的发生率为13.4%,与文献中描述的2%~15%相一致。如先前的研究所示,肺是最易受累及的器官,其次是骨骼和肝脏。
T分期T3、T4,N分期N2、N3,肿瘤厚度,PNI,ECS,颈部和局部复发,临床/病理分期IV期,对侧颈部受累等因素与初次手术后发生远处转移的风险密切相关。这些数据与其他分析发生远处转移相关危险因素的研究具有可比性[3,4,10]。关于肿瘤厚度需要强调的是,只有厚度>1 cm的肿瘤才与远处转移显著相关,且既往没有研究对肿瘤厚度的3个不同亚组进行过分析。例如,艾雷斯等人将肿瘤厚度分为<0.25 cm和>0.25 cm两组,并发现厚度>0.25 cm的肿瘤与远处转移风险较高相关[10]。然而,绝大多数口腔肿瘤的厚度均>0.25 cm,因此更准确地预估与发生远处转移风险相关的肿瘤厚度可能具有重要的临床意义。事实上,术前通过精确的影像学检查可以更准确地估计肿瘤厚度,这有助于识别那些由于颈部或远处转移风险而需要更积极的临床或手术治疗的患者。
van der Kamp 等的研究以及其他几项研究表明,颈部转移是远处转移的重要危险因素[3,10-12]。此外,当有Ⅳ期或Ⅴ期中出现多个淋巴结阳性或对侧颈部受累时,这种风险更大。本研究发现,N分期N2、N3期是远处转移的独立危险因素,颈部转移是本研究中的主要危险因素(HR=3.068;P<0.001),颈部或局部复发的相关性排在第二(HR=3.082;P<0.001)。
关于PNI与远处转移之间的关系,文献中存在争议。虽然有研究报道了这两个变量之间的密切相关性(PNI与发生远处转移的风险较高相关),但其他研究没有发现这种相关性,例如Aires等报道PNI并不是远处转移的危险因素[10]。本研究中,伴有PNI的患者在随访期间出现远处转移的风险高1.639倍。其他几项研究也报道了PNI与颈部转移、复发(原位、颈部和局部)和较差预后之间的相关性[3,10,13,14],因此可以认为PNI也可能在发生远处转移中起关键作用。
此外,一些研究报道血管侵犯与远处转移高风险之间的相关性[9,10,15-20],但本研究未发现血管侵犯是发生远处转移的相关因素(P>0.005)。
令人关注的是,在样本群体中,35%(n=14)的患者在术后3个月内通过辅助治疗前或结束后进行的胸部CT或PET扫描被诊断为远处转移(所有患者中占比4.7%)。但在根治术前无法确定这些患者是否已经出现了肿瘤的远处转移。然而,有理由认为这些患者在接受初次手术前出现远处转移,并且我们的分期方案无法检测到这一现象,特别是在有肿瘤局部控制的情况下。如前所述,伴发两个或以上危险因素(T分期T3、T4,N分期N2、N3,肿瘤厚度,PNI,ECS,颈部和局部复发,临床/病理分期IV期)的患者发生远处转移的风险将增加4倍以上。细致的术前评估可以对肿瘤厚度>1 cm,T分期T3、T4,颈部转移和疾病临床分期进行准确判断(图2)。本研究的局限之一是没有对转移淋巴结的数量和位置进行分析,彼得斯等人指出这可能是发生远处转移极其重要的相关因素[21]。由于本研究中部分患者的颈部标本没有被特别标记和定位,因此我们没有对其进行分析。之后的研究中对这些变量的分析可能可以更好地理解与发生远处转移的相关性。本研究的另一个不足是仅对肿瘤厚度而没有对侵袭深度(depth of invasion,DOI)进行分析。肿瘤厚度涉及肿瘤的直径,但DOI代表肿瘤发生的基底膜至侵袭最深处的距离。最近,一些研究表明DOI比肿瘤厚度具有更高的预后价值[22]。但本研究分析的患者中未记录DOI,我们认为未来研究中对这一因素的分析有助于提高我们对远处转移现象的认识。
结论
对于涉及2个及以上远处转移危险因素的患者,术前进行胸部CT或PET扫描有助于明确早期远处转移灶。由于肺部转移高发,胸部CT将足以识别大多数远转病例。在这方面,胸部CT扫描具有足够的灵敏度和特异性来检测肺部和纵膈转移。但在头颈部转移的早期检测中,CT和PET扫描哪种技术更具优势还存在一定争议,Uyl-de Groot等认为,PET扫描具有更高的成本效益[23]。我们认为,本研究报道的方案将有助于识别早期远处转移的患者,有助于为每位患者制定适宜的治疗方案,这也将降低大型手术的相关并发症。
Acknowledgments
Funding: None.
Footnote
Data Sharing Statement: Available at https://fomm.amegroups.org/article/view/10.21037/fomm-21-13/dss
Peer Review File: Available at https://fomm.amegroups.org/article/view/10.21037/fomm-21-13/prf
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at https://fomm.amegroups.org/article/view/10.21037/fomm-21-13/coif). PC serves as an unpaid editorial board member of Frontiers of Oral and Maxillofacial Medicine from Apr 2020 to Mar 2022. The other authors have no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved. Ethical approval is not required by our institution for retrospective study. All procedures performed in studies involving human participants were in accordance with the ethical standards of the institutional and/or national research committee(s) and with the Helsinki Declaration (as revised in 2013). Written informed consent was obtained from the patient.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- TOPAZIAN DS. Distant metastasis of oral carcinoma. Oral Surg Oral Med Oral Pathol 1961;14:705-11. [Crossref] [PubMed]
- Calhoun KH, Fulmer P, Weiss R, et al. Distant metastases from head and neck squamous cell carcinomas. Laryngoscope 1994;104:1199-205. [Crossref] [PubMed]
- Liu JC, Bhayani M, Kuchta K, et al. Patterns of distant metastasis in head and neck cancer at presentation: Implications for initial evaluation. Oral Oncol 2019;88:131-6. [Crossref] [PubMed]
- Alvi A, Johnson JT, et al. Development of distant metastasis after treatment of advanced-stage head and neck cancer. Head Neck 1997;19:500-5. [Crossref] [PubMed]
- Coca-Pelaz A, Rodrigo JP, Suárez C, et al. Clinicopathologic analysis and predictive factors for distant metastases in patients with head and neck squamous cell carcinomas. Head Neck 2012;34:771-5. [Crossref] [PubMed]
- Head and neck tumours. In: Sobin LH, Wittekind C. editors. UICC TNM classification of malignant tumours. 5th edition. New York: John Wiley & Sons, 1997:17-32.
- Moeckelmann N, Ebrahimi A, Tou YK, et al. Prognostic implications of the 8th edition American Joint Committee on Cancer (AJCC) staging system in oral cavity squamous cell carcinoma. Oral Oncol 2018;85:82-6.
- Lim JY, Lim YC, Kim SH, et al. Predictive factors of isolated distant metastasis after primary definitive surgery without systemic treatment for head and neck squamous cell carcinoma. Oral Oncol 2010;46:504-8. [Crossref] [PubMed]
- Chen TC, Hsu CW, Lou PJ, et al. The clinical predictive factors for subsequent distant metastasis in patients with locoregionally advanced oral squamous cell carcinoma. Oral Oncol 2013;49:367-73. [Crossref] [PubMed]
- Aires FT, Lin CS, Matos LL, et al. Risk Factors for Distant Metastasis in Patients with Oral Cavity Squamous Cell Carcinoma Undergoing Surgical Treatment. ORL J Otorhinolaryngol Relat Spec 2017;79:347-55. [Crossref] [PubMed]
- Leemans CR, Tiwari R, Nauta JJ, et al. Regional lymph node involvement and its significance in the development of distant metastases in head and neck carcinoma. Cancer 1993;71:452-6. [Crossref] [PubMed]
- van der Kamp MF, Muntinghe FOW, Iepsma RS, et al. Predictors for distant metastasis in head and neck cancer, with emphasis on age. Eur Arch Otorhinolaryngol 2021;278:181-90. [Crossref] [PubMed]
- Cariati P, Cabello Serrano A, Mosalve Iglesias F, et al. What is the real prognostic value of close margins in oral oncology? Curr Probl Cancer 2019;43:100500 [Crossref] [PubMed]
- Rahima B, Shingaki S, Nagata M, et al. Prognostic significance of perineural invasion in oral and oropharyngeal carcinoma. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2004;97:423-31. [Crossref] [PubMed]
- Adel M, Kao HK, Hsu CL, et al. Evaluation of Lymphatic and Vascular Invasion in Relation to Clinicopathological Factors and Treatment Outcome in Oral Cavity Squamous Cell Carcinoma. Medicine (Baltimore) 2015;94:e1510 [Crossref] [PubMed]
- Liao CT, Wang HM, Chang JT, et al. Analysis of risk factors for distant metastases in squamous cell carcinoma of the oral cavity. Cancer 2007;110:1501-8. [Crossref] [PubMed]
- Uchiyama Y, Sasai T, Nakatani A, et al. Distant metastasis from oral cavity-correlation between histopathology results and primary site. Oral Radiol 2021;37:167-79. [Crossref] [PubMed]
- Sekikawa S, Kawachi H, Ogane S, et al. Which Factors Affect the Long-Term Survival of Patients With Oral Squamous Cell Carcinoma With Distant Metastasis? J Oral Maxillofac Surg 2020;78:469-78. [Crossref] [PubMed]
- Tomioka H, Yamagata Y, Oikawa Y, et al. Risk factors for distant metastasis in locoregionally controlled oral squamous cell carcinoma: a retrospective study. Sci Rep 2021;11:5213. [Crossref] [PubMed]
- LU HJ. Predictive scoring systems for distant metastases in oral cavity squamous cell carcinoma. J Clin Oncol 2020; [Crossref]
- Peters TT, Senft A, Hoekstra OS, et al. Pretreatment screening on distant metastases and head and neck cancer patients: Validation of risk factors and influence on survival. Oral Oncol 2015;51:267-71. [Crossref] [PubMed]
- Piazza C, Bresciani L, Giannini L, et al. Depth of invasion for prognostic stratification in oral cavity cancer: do we need further validation? Ann Transl Med 2019;7:S84. [Crossref] [PubMed]
- Uyl-de Groot CA, Senft A, de Bree R, et al. Chest CT and whole-body 18F-FDG PET are cost-effective in screening for distant metastases in head and neck cancer patients. J Nucl Med 2010;51:176-82. [Crossref] [PubMed]

郭毅波
口腔临床医学八年制,上海交通大学医学院附属第九人民医院口腔颌面-头颈肿瘤科博士研究生在读,师从季彤教授。曾获博士研究生国家奖学金,主持完成上海市级大学生创新训练计划项目一项,于国内核心期刊发表论文2篇,多次获上海交通大学优秀奖学金,以优异成绩完成UCLA CDS Summer Program项目,获评上海市口腔健康科普短视频创新活动优秀科普作品一项,多次参与“丝路杯”、口腔专业虚拟情景化等口腔临床技能邀请赛并获奖。主要从事口腔颌面外科临床实践及口腔颌面部肿瘤发生发展、肿瘤神经学相关基础研究。(更新时间:2022-08-05)

季彤
上海交通大学医学院教授,主任医师,博士研究生导师,现就职于上海交通大学医学院附属第九人民医院口腔颌面头颈肿瘤科,任党总支书记,行政副主任,教研室主任。1993年7月毕业于华西医科大学口腔医学院,2004年7月毕业于上海第二医科大学口腔医学院获博士学位。现任中华口腔医学会口腔颌面头颈肿瘤专业委员会常委,中国抗癌协会头颈肿瘤专业委员会常委、青年委员会副主任委员,中国医疗保健国际交流促进会颅底外科专业委员会常委,中国医师协会显微外科分会委员,上海口腔医学会口腔颌面-头颈肿瘤专业委员会副主任委员,上海抗癌协会头颈肿瘤专业委员会副主任委员,上海抗癌协会肉瘤专业委员会常委。香港大学牙学院荣誉教授(Honorary Professor),国际内固定协会(AO/ASIF)颅颌面(CMF)中国区主席、亚太区理事,国际口腔颌面外科医师协会(IAOMS)肿瘤与修复重建培训中心、英国爱丁堡皇家外科学院头颈肿瘤培训中心主要成员。国际口腔癌协会(IAOO)会员,美国头颈协会(AHNS)会员。
目前科研方向包括:神经-肿瘤交互对口腔肿瘤发生发展的调控,头颈部肉瘤的基础与临床研究,手术机器人等新技术在颌面头颈肿瘤与修复重建中应用。(更新时间:2022-08-05)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Cariati P, Pampin Ozan D, Gonzalez Corcóles C, Tursun R, Arroyo Rodriguez S. Risk factors for distant metastasis in oral cancer and a strategy preoperative detection. Front Oral Maxillofac Med 2021;3:24.