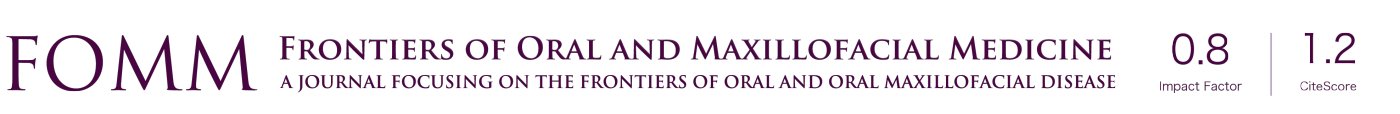肉毒杆菌毒素
前言
肉毒杆菌毒素(肉毒素,Botox)来源于革兰氏阳性厌氧菌肉毒杆菌。有7种不同的血清型 (A~G),对神经传递具有生物学效应。肉毒素的作用机制涉及以下4个基本步骤:
- 肉毒素通过突触囊泡蛋白2(SV2)和/或突触结合蛋白(取决于血清型)与神经元突触前膜结合;
- 通过内吞作用将肉毒素内化;
- 肉毒素从内吞囊泡转移到神经元胞浆;
- 参与神经胞吐作用的特定蛋白质的酶切,包括肉毒杆菌A、E和C酶切SNAP-25;肉毒杆菌毒素B、D、F和G酶切VAMP/突触小泡缔合性膜蛋白;肉毒杆菌C裂解酶切前膜蛋白。
这些蛋白质酶切的最终结果是抑制了可溶性 N-乙基马来酰亚胺敏感因子附着蛋白受体 (SNARE) 的形成,这些受体对于含有乙酰胆碱 (Ach) 的突触小泡与突触前神经元膜的融合至关重要。这有效地防止了 Ach 从神经肌肉接头处的运动终板释放。最终结果是肌肉持续麻痹,直到内源性神经元蛋白(SNAP-25、VAMP 和突触前膜蛋白)在接下来的 3~6 个月内再生。
肉毒素最初被认为通过抑制肌肉活动来减少口面部疼痛。目前的证据表明,肉毒素还具有镇痛作用,因为它能够抑制P物质(SP)、降钙素基因相关肽(CGRP)和瞬时受体电位(TRP)香草酸受体1型(TRPV1)的释放。这意味着外周和中枢神经系统(CNS)的疼痛和神经源性炎症减轻。这一过程可能与肉毒素阻断神经肌肉传递的能力存在协同效应。
一般适应证
虽然肉毒素最初于1989年获得美国食品药品监督管理局(FDA)的批准,但批准的适应证清单已经扩大到包括膀胱过度活跃症、头痛、痉挛、肌张力障碍、眼睑痉挛和多汗症等。它可以经肌肉内或皮内技术进行给药。在肌肉注射期间使用肌电图(EMG)监测有助于在注射期间定位运动终板。成人的最大剂量为3个月内400单位,或儿童患者为300单位或8单位/kg,以较小剂量者为准。任何给定患者的肉毒素剂量取决于其使用的适应证。使用肉毒素后的并发症极为罕见,但可能包括肉毒素的远处扩散导致虚弱乏力、全身肌肉无力、复视、上睑下垂、吞咽困难、发音困难、构音障碍、尿失禁和呼吸困难。肉毒素不应用于对肉毒杆菌过敏或过度(或注射部位有)皮肤感染的患者。
口面部疼痛可能由多种原因造成,这使得诊断和治疗具有挑战性。尽管颞下颌关节紊乱病(TMD)是一个非特定术语,但颞下颌关节紊乱病的诊断标准(DC/TMD)为区分TMD的疼痛来源提供了一种有效的方案。轴I描述了疼痛来源,分为关节源性和肌源性。
与颞下颌关节相关的关节源性疼痛包括:
- 关节痛;
- 可复性关节盘移位;
- 可复性关节盘移位伴间歇性绞锁;
- 不可复性关节盘移位伴张口受限;
- 不可复性关节盘移位无张口受限;
- 退行性关节病;
- 关节半脱位。
肌源性疼痛源与咀嚼肌有关,包括:
- 肌痛;
- 局限型肌痛;
- 肌筋膜痛;
- 牵涉型肌筋膜痛;
- TMD所致的头痛。
此外,DC/TMD 提倡使用筛查工具和有效的问卷来鉴定 轴II 诊断,例如不良疼痛行为、心理问题和心理社会功能。这些因素可预测轴I诊断的治疗反应。同样值得注意的是,TMD患者还可能伴有颈部疼痛、偏头痛、磨牙症、口面肌张力障碍、三叉神经痛 (TN)、纤维肌痛和肠易激综合征。肉毒素可能有利于改善上述某些情况。
注射技术
肉毒素以 50 单位、100 单位和 200 单位的小瓶形式提供。它需要用无菌生理盐水复溶。通常这需要分别为 50 单位、100 单位和 200 单位的小瓶添加 1 mL、2 mL或 4 mL 的无菌生理盐水。 此时溶液的平均浓度为每0.1 mL含 5单位肉毒素。小瓶为一次性使用,应在配制后 24 小时内使用。配制后如不立即使用的复溶液应保存在4 ℃冷藏室中。应选择运动终板密度最大的解剖位置进行肌肉注射。
口腔颌面外科的适应证
慢性偏头痛
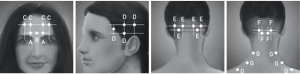
慢性偏头痛定义为每月头痛≥15 天,头痛持续时间超过4小时。肉毒素已被证明可以减少头痛发作的频率和强度[1-4]。确切的作用机制尚不清楚。一种观点认为,继发于谷氨酸和CGRP的降低,肉毒素可降低颅肌痛觉感受器的机械敏感性。另一个潜在的机制是三叉神经系统内SP和CGRP的降低。某些特定的肌肉和注射部位已被证明是有益的(图1)。
肌筋膜痛
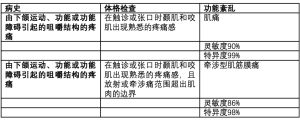
根据 DC/TMD,肌痛和牵涉性肌筋膜痛是2种可确诊的肌源性轴I诊断[5]。肌痛和牵涉性肌筋膜痛的诊断依靠病史和体格检查(表1)。
Full table
导致TMD的局部肌痛、肌筋膜疼痛和头痛仍然是额外的肌源性轴I诊断,但患者的病史和体检通常不足以对这些情况提供足够的灵敏度或特异度。轴I肌源性疼痛的病理生理学尚不明确,既往理论提出其与神经、肌源性和心理因素等相关[6]。肉毒素已被证明可以减轻轴I诊断中的肌源性疼痛[7-9]。当存在磨牙症和/或精神压力相关的合并症时,疼痛减轻程度似乎更显著[10]。咬肌肉毒素注射最理想的部位是咬肌下1/3和中1/3的交界处。颞肌肉毒素注射最理想的位置是肌腹的中点。将总量50单位的肉毒素注射到每个咬肌和颞肌中,每个注射部位的单位剂量相同。最后双侧咬肌和颞肌的总剂量为200单位(图2)。
口面部运动障碍
口面部运动障碍包括口面部肌张力障碍和口面部运动功能障碍,可累及多种口面部肌肉,包括颈阔肌、口轮匝肌、颊肌、颏舌肌、颏舌骨肌、二腹肌和舌内肌。最终的结果可能是不自主的下颌张开、紧咬牙、舌前推和面部抽搐。当咬肌、颞肌、翼内肌受累时,它们有可能导致TMD[11,12]。当翼外肌受累时,也可能导致颞下颌关节脱位[13-15]。这些运动障碍的病因尚不清楚,对中枢和周围神经系统的检查通常也未见明显异常。治疗通常是使用药物,包括苯二氮䓬类药物、抗胆碱能药物、左旋多巴、溴隐亭和巴氯芬。肉毒素仍然是一种有效的治疗方法,特别是对于局灶性肌张力障碍和运动障碍的治疗。
当涉及颞肌和咬肌时,注射技术与针对肌筋膜疼痛所描述的一样。翼内肌的注射更具挑战性。翼内肌注射肉毒素有2种基本操作入路,且均需要在EMG引导下进行。第一种注射方式可使用1.5英寸的针头进行口腔内注射,注射位置位于翼突下颌缝外侧,与下颌升支平行。这方法类似于下牙槽神经阻滞,但需注意将注射针平行于下颌升支内侧面。肉毒素的剂量通常为20个单位。另一种适用于瘦弱患者的注射方法是在下颌角前切迹下方经口外入路。它同样需要 1.5 英寸针头。用非优势手的食指将紧靠下颌角前切迹下方的皮肤和软组织向内侧推移,以容许肉毒素针从下方插入。针头与下颌支的内侧面保持平行,以确保朝向翼内肌。如将针头在针座处弯曲约30度,以保证握持注射器的手位于颈部外侧,则可相对简单地进行注射操作。肉毒菌注射后的并发症并不常见,但是由于翼内肌位于颞下窝内,因此有可能会扩散并导致发声困难和吞咽困难。
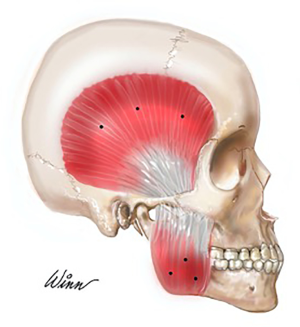
翼外肌注射肉毒素在技术上更容易。与翼内肌的注射技术一样,翼外肌注射肉毒素在EMG引导下采取2种注射方法。第一种也是最简单的方法是紧靠上颌结节后方进行口内注射。使用压舌板向外牵拉颊部,嘱患者小张口分开上下颌牙列,弯曲注射针呈30度,于上颌结节后侧朝向内上方进针,直至遇到翼突外侧板[13]。通常15~25个单位的肉毒杆菌素便足够(图3A-图3D)。
口外入路的技术更具挑战性。它需要将一根直针直接插入关节结节下方并穿过乙状切迹。针头保持水平,但指向略微向前。
神经病理性疼痛
肉毒素还可以抑制神经调节剂和递质的分泌,从而减轻中枢神经性疼痛,其作用机制包括减少兴奋性谷氨酸、SP和CGRP的释放等。此外,肉毒素可降低TRPV1的表达,该基因同辣椒素诱发和钙通道响应相关[16,17]。
使用肉毒素进行神经病理性疼痛控制的注射技术是独特的,因为肉毒素被皮下注射到覆盖神经病理性疼痛的皮节中。剂量有所变化,但通常每平方厘米 (cm2)皮肤注射5个单位的肉毒素就足够了。该过程不需要EMG引导,可以用结核菌素针完成,以减少注射过程中的不适。
TN
TN不是神经病理性疼痛的同义词。TN的病因仍不明确,但有观点认为小脑上动脉骑跨性压迫三叉神经根可导致神经局灶性脱髓鞘病变,引发疼痛发作。其他TN的病因包括肿瘤、多发性硬化症和病毒后综合症。TN主要的治疗方法是药物治疗,包括卡马西平、奥卡西平(oxycarbamazepine)、苯妥英钠(phenytoin)、加巴喷丁(gabapentin)、普瑞巴林(pregabalin)和巴氯芬(baclofen)等。手术治疗包括半月神经节神经根切断术、伽玛刀和微血管减压术[18-20]。
肉毒素治疗TN的作用机制被认为与治疗神经病理性疼痛的作用机制相似。注射技术也是相同的。神经性疼痛和TN的最大疼痛减轻时间为4~8周后。这比肌肉注射的1~2周长得多,可能反映了肉毒素需经轴突逆行转运到中枢神经系统发挥作用。
磨牙症
据报道,肉毒素对治疗睡眠相关磨牙症有积极作用[21,22],可以降低咬肌和颞肌内的肌肉活动强度,同时减少了自我报告的疼痛和下颌僵硬。注射技术和剂量与肌筋膜疼痛相同。
弗雷综合征
弗雷综合征是腮腺和颞下颌关节手术后的一种罕见的并发症。它会导致进食时味觉性出汗。腮腺通过涉及耳颞神经和Ach释放的复杂神经通路接受副交感神经分泌神经支配。
皮肤的汗腺由源自颈上神经节的交感神经纤维支配,交感神经纤维通过同一耳颞神经行进。腮腺和颞下颌关节手术被认为会损伤耳颞神经,导致上覆汗腺的副交感神经支配不当。这会导致咀嚼过程中大量出汗。弗雷综合征的诊断可通过微量碘/淀粉试验进行。该测试还将显示受影响的确切皮肤区域。这应该用皮肤标记勾勒出轮廓。可以使用结核菌素注射器/针头皮下注射肉毒素,剂量为每平方厘米受累皮肤注射5个单位。治疗效果将在一周内显现,并可维持3~6个月[23]。
流涎
唾液分泌过多或无法充分吞咽唾液可能会导致流涎。这通常见于神经系统疾病患者,包括发育迟缓、脑瘫、肌萎缩侧索硬化、帕金森病、脑血管意外和创伤性脑损伤的患者。诸如格隆溴铵等抗唾液酸药物的疗效有限,并会导致全身性副作用。也有报道采用外科手术方法,如唾液腺导管结扎术和唾液腺导管成形术,以实现唾液腺导管改道。使用肉毒素来减少流涎已经越来越广泛,并取得了有希望的结果 [24-26]。腮腺和颌下腺注射技术相对简单。推荐使用超声来定位腺体并进行适当的腺体内注射。理想的剂量取决于腺体的大小、唾液分泌的量以及流涎的严重程度。据报道,每个腺体的剂量为5~40个单位。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Stephen Feinberg and Louis Mercuri) for the series “Temporomandibular Joint Disorders Diagnosis and Management – What Does the Future Hold?” published in Frontiers of Oral and Maxillofacial Medicine. The article has undergone external peer review.
Conflicts of Interest: The author has completed the ICMJE uniform disclosure form (available at https://fomm.amegroups.com/article/view/10.21037/fomm-20-42/coif). The series “Temporomandibular Joint Disorders Diagnosis and Management – What Does the Future Hold?” was commissioned by the editorial office without any funding or sponsorship. The author has no other conflicts of interest to declare.
Ethical Statement: The author is accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Gazerani P, Au S, Dong X, et al. Botulinum neurotoxin type A (BoNTA) decreases the mechanical sensitivity of nociceptors and inhibits neurogenic vasodilation in a craniofacial muscle targeted for migraine prophylaxis. Pain 2010;151:606-16. [Crossref] [PubMed]
- Kleen JK, Levin M. Injection therapy for headache and facial pain. Oral Maxillofac Surg Clin North Am 2016;28:423-34. [Crossref] [PubMed]
- Frampton JE. OnabotulinumtoxinA (BOTOX®): a review of its use in the prophylaxis of headaches in adults with chronic migraine. Drugs 2012;72:825-45. [Crossref] [PubMed]
- Luvisetto S, Gazerani P, Cianchetti C, et al. Botulinum toxin type a as a therapeutic agent against headache and related disorders. Toxins (Basel) 2015;7:3818-44. [Crossref] [PubMed]
- Schiffman E, Ohrbach R. Executive summary of the Diagnostic Criteria for Temporomandibular Disorders for clinical and research applications. J Am Dent Assoc 2016;147:438-45. [Crossref] [PubMed]
- Fallah HM, Currimbhoy S. Use of botulinum toxin A for treatment of myofascial pain and dysfunction. J Oral Maxillofac Surg 2012;70:1243-5. [Crossref] [PubMed]
- Sunil Dutt C, Ramnani P, Thakur D, et al. Botulinum toxin in the treatment of muscle specific Oro-facial pain: a literature review. J Maxillofac Oral Surg 2015;14:171-5. [Crossref] [PubMed]
- Baker JS, Nolan PJ. Effectiveness of botulinum toxin type A for the treatment of chronic masticatory myofascial pain: a case series. J Am Dent Assoc 2017;148:33-9. [Crossref] [PubMed]
- Sidebottom AJ, Patel AA, Amin J. Botulinum injection for the management of myofascial pain in the masticatory muscles. A prospective outcome study. Br J Oral Maxillofac Surg 2013;51:199-205. [Crossref] [PubMed]
- Connelly ST, Myung J, Gupta R, et al. Clinical outcomes of Botox injections for chronic temporomandibular disorders: do we understand how Botox works on muscle, pain, and the brain? Int J Oral Maxillofac Surg 2017;46:322-7. [Crossref] [PubMed]
- Bakke M, Baram S, Dalager T, et al. Oromandibular dystonia, mental distress and oro-facial dysfunction-A follow-up 8-10 years after start of treatment with botulinum toxin. J Oral Rehabil 2019;46:441-9. [Crossref] [PubMed]
- Clark GT, Ram S. Orofacial movement disorders. Oral Maxillofac Surg Clin North Am 2016;28:397-407. [Crossref] [PubMed]
- Mendes RA, Upton LG. Management of dystonia of the lateral pterygoid muscle with botulinum toxin A. Br J Oral Maxillofac Surg 2009;47:481-3. [Crossref] [PubMed]
- Renapurkar SK, Laskin DM. Injectable agents versus surgery for recurrent temporomandibular joint dislocation. Oral Maxillofac Surg Clin North Am 2018;30:343-9. [Crossref] [PubMed]
- Yoshida K. Botulinum neurotoxin injection for the treatment of recurrent temporomandibular joint dislocation with and without neurogenic muscular hyperactivity. Toxins (Basel) 2018;10:174. [Crossref] [PubMed]
- Park J, Chung ME. Botulinum toxin for central neuropathic pain. Toxins (Basel) 2018;10:224. [Crossref] [PubMed]
- Moreau N, Dieb W, Descroix V, et al. Topical review: potential use of botulinum toxin in the management of painful posttraumatic trigeminal neuropathy. J Oral Facial Pain Headache 2017;31:7-18. [Crossref] [PubMed]
- Burmeister J, Holle D, Bock E, et al. Botulinum neurotoxin type A in the treatment of classical Trigeminal Neuralgia (BoTN): study protocol for a randomized controlled trial. Trials 2015;16:550. [Crossref] [PubMed]
- Castillo-Álvarez F, Hernando de la Bárcena I, Marzo-Sola ME. Botulinum toxin in trigeminal neuralgia. Med Clin (Barc) 2017;148:28-32. [Crossref] [PubMed]
- Li S, Lian YJ, Chen Y, et al. Therapeutic effect of Botulinum toxin-A in 88 patients with trigeminal neuralgia with 14-month follow-up. J Headache Pain 2014;15:43. [Crossref] [PubMed]
- De la Torre Canales G, Camara-Souza MB, do Amaral CF, et al. Is there enough evidence to use botulinum toxin injections for bruxism management? A systematic literature review. Clin Oral Investig 2017;21:727-34. [Crossref] [PubMed]
- Shim YJ, Lee MK, Kato T, et al. Effects of botulinum toxin on jaw motor events during sleep in sleep bruxism patients: a polysomnographic evaluation. J Clin Sleep Med 2014;10:291-8. [Crossref] [PubMed]
- Jansen S, Jerowski M, Ludwig L, et al. Botulinum toxin therapy in Frey's syndrome: a retrospective study of 440 treatments in 100 patients. Clin Otolaryngol 2017;42:295-300. [Crossref] [PubMed]
- Alvarenga A, Campos M, Dias M, et al. BOTOX-A injection of salivary glands for drooling. J Pediatr Surg 2017;52:1283-6. [Crossref] [PubMed]
- Sridharan K, Sivaramakrishnan G. Pharmacological interventions for treating sialorrhea associated with neurological disorders: a mixed treatment network meta-analysis of randomized controlled trials. J Clin Neurosci 2018;51:12-7. [Crossref] [PubMed]
- Weitzman RE, Kawai K, Nuss R, et al. A 10-year retrospective review of botulinum toxin injections and surgical management of sialorrhea. Cureus 2020;12:e7916. [Crossref] [PubMed]

陈一菁
2008年从南方医科大学临床医学本科毕业,进入南方医科大学珠江医院参加“3+2”模式的专科临床医师规范化培训并留院工作,2014年考入南方医科大学人体解剖与组织胚胎学研究生,2017年获得硕士学位,随后在南方医科大学珠江医院儿科中心工作至2021年9月。自2021年10月在点亮童年儿童康复中心工作至今。主要从事儿童神经发育及康复相关工作,既往在南方医科大学珠江医院儿科工作期间,师从方素珍教授进行儿童肉毒毒素相关治疗。目前是南方医科大学康复医学院外聘讲师。目前具有INPP(The Institute for neuro physiological psychology, UK)全球执业资格,ASHA国际会员,OPT Level 2。(更新时间:2023-07-25)

陈启铭
博士研究生。2013年至2018年于南京医科大学学习,获口腔医学学士学位,2018年至2021年于上海交通大学医学院附属第九人民医院学习,获口腔临床医学硕士学位。2021年9月至今于上海交通大学医学院附属第九人民医院攻读口腔临床医学博士学位。以第一作者身份于Science Advances、Journal of Dental Research等杂志发表SCI论文数篇。(更新时间:2023-07-25)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Bouloux GF. Botulinum toxin (Botox). Front Oral Maxillofac Med 2022;4:4.